



2020年12月4日,国际学术期刊Science Advances在线发表了国家蛋白质科学研究(上海)设施用户中科院分子细胞科学卓越创新中心丛尧团队与中科院上海巴斯德研究所黄忠团队的合作研究论文“Conformational dynamics of SARS-CoV-2 trimeric spike glycoprotein in complex with receptor ACE2 revealed by cryo-EM”。该研究应用冷冻电镜结合生化分析,解析了新冠病毒刺突蛋白三聚体结合受体ACE2的高分辨率冷冻电镜结构,揭示了ACE2诱导刺突蛋白动态构象转变的分子机制,为深入理解新冠病毒侵染细胞的机制提供了结构基础,并为设计和优化旨在阻断受体结合的疫苗和治疗药物提供重要信息。
新冠病毒(SARS-CoV-2)引起的新冠病毒肺炎于2020年在全球大流行,引发公共健康危机。新冠病毒表面的刺突蛋白(S)是一种膜融合机器,S蛋白三聚体与受体人ACE2结合,介导病毒进入宿主细胞,是感染过程中体液免疫反应的主要目标。但新冠病毒侵染细胞的分子机制亟待阐明。S蛋白由受体结合亚基S1和膜融合亚基S2组成。 S1包含受体结合结构域(RBD),S2以融合肽(FP)开始,该肽插入宿主细胞膜中, 促进宿主细胞膜与病毒膜的融合。S蛋白三聚体作为一个完整的变构机器如何对受体ACE2的结合作出反应,以及该事件如何触发S三聚体从关闭的融合前态(prefusion state)向融合后态(postfusion state)的构象转变有待阐明。此外,据报道新冠病毒的S蛋白D614G突变株可增强该病毒的感染性,但其潜在的结构基础仍未完全了解。
为全面了解完整S蛋白三聚体对受体ACE2结合的变构反应,丛尧团队解析了分辨率为2.7 埃的新冠病毒S三聚体紧密闭合(tightly closed)状态及3.8埃分辨率的S三聚体结合受体ACE2的冷冻电镜结构(图1A、B)。S三聚体紧密闭合状态下融合肽(FP)稳定结合,且S蛋白的受体结合域(RBD)包埋在结构内部,这种构象掩蔽(conformational masking)机制可能有助于新冠病毒逃避宿主免疫系统的识别。伴随ACE2与S蛋白一个向上的RBD结合,诱发S蛋白构象由原来紧密闭合的融合前态向有利于融合的开放状态的转变;结合的ACE2-RBD在S三聚体中表现出连续的摆动,激活相连的S1亚基有利于其整体脱离,使S三聚体向融合后状态转化(图1D)。新冠病毒S蛋白在ACE2诱发下的构象转化比SARS病毒的S蛋白更为敏感,这可能是新冠病毒具有更强感染力的原因。黄忠团队结合结构信息及生化分析,还发现了新冠病毒RBD上的T470-T478 loop及Y505残基是新冠病毒特异性识别ACE2受体的关键区域。此外,该研究为SARS-CoV-2的S蛋白D614G突变株诱导的感染力增强提供了结构基础(图1C),并描绘了FP在稳定S三聚体中的特定作用以及FP被激活的机制。
总之,该研究揭示了新冠病毒基于动力学(dynamics-based)的免疫逃逸机制及其S蛋白三聚体的受体识别机制,阐明了ACE2诱导的S三聚体构象从融合前基态向融合后状态逐渐转变的动态分子机制,为深入理解新冠病毒侵染细胞的机制提供了结构基础,并为设计和优化旨在阻断受体结合的疫苗和治疗药物提供重要信息。且该工作已于2020年6月30日登载于BioRxiv。
该研究是蛋白质设施“新冠肺炎病毒相关研究的快捷绿色通道”批复的课题,在疫情期间得到了设施的大力支持,设施的冷冻电镜系统在电镜数据的收集和海量计算方面提供了支持;规模化蛋白质制备系统及数据库和计算分析系统也为该研究提供了技术支持。
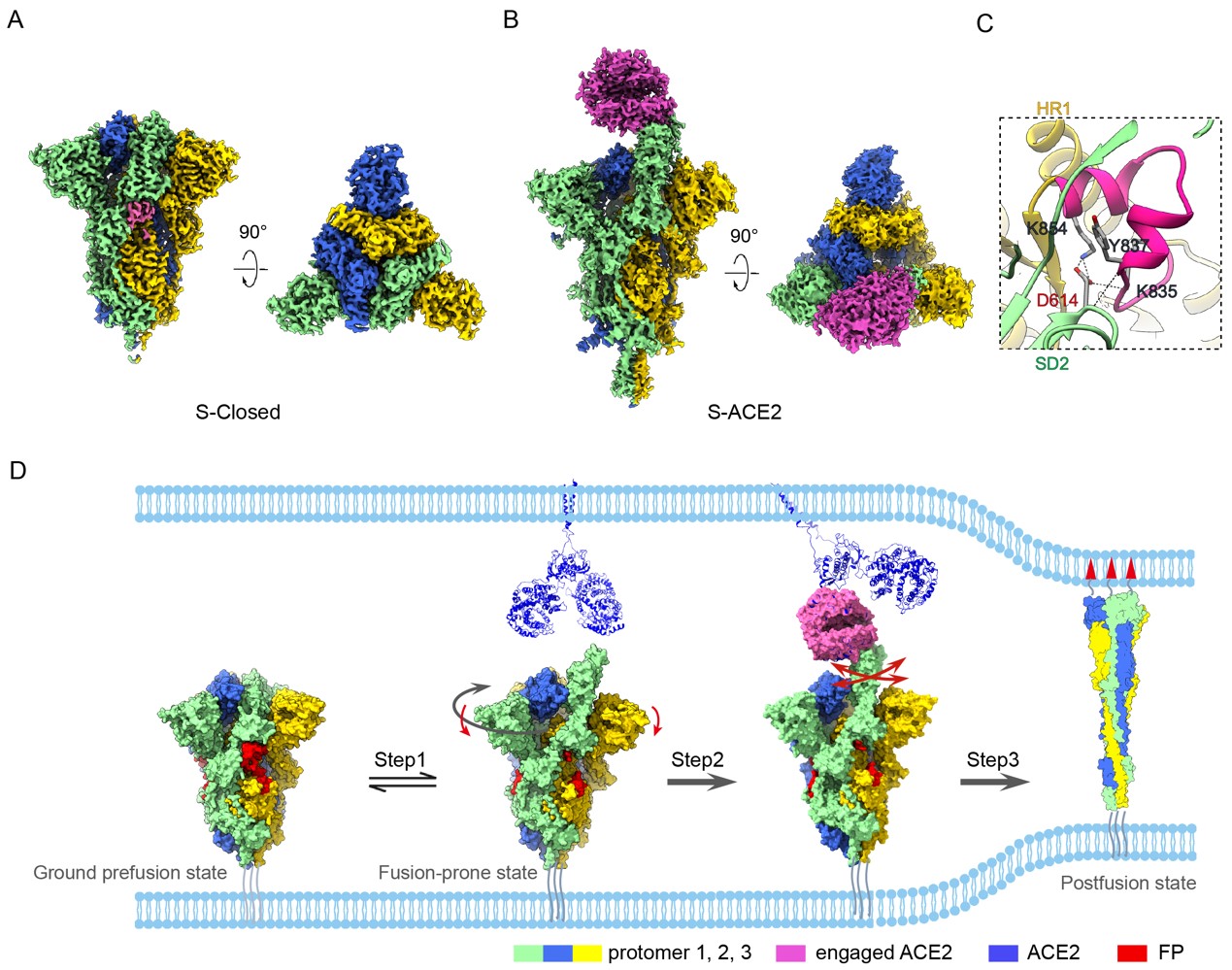
图1、(A)新冠病毒刺突蛋白三聚体紧密闭合构象的2.7埃分辨率的冷冻电镜结构。(B)刺突蛋白结合受体ACE2形成复合体的3.8埃分辨率的冷冻电镜结构。ACE2紫红色表示。(C)刺突蛋白SD2结构域的D614与相邻亚基的FP(深粉色)之间形成氢键作用网络的放大图。(D)ACE2诱导刺突蛋白三聚体从prefusion状态向postfusion状态的动态转变分子机制示意图。
(蛋白质设施上海提供)