



卡波氏肉瘤相关疱疹病毒(Kaposi’s sarcoma-associated herpesvirus,KSHV)和爱泼斯坦-巴尔病毒(Epstein-Barr virus,EBV)属于γ疱疹病毒亚科,是与恶性肿瘤密切相关的人类癌症相关病毒。2020年11月24日,国家蛋白质设施用户高福院士团队在国际权威学术期刊Nature Communications上在线发表了题为“Molecular basis of EphA2 recognition by gHgL from gammaherpesviruses”的研究论文,分别解析了KSHV以及EBV糖蛋白gHgL与其共同受体EphA2的复合物晶体结构,揭示了这两种感染人γ疱疹病毒利用gHgL结合受体EphA2的分子机制,并提供了EphA2可能作为γ疱疹病毒通用受体的证据,暗示了其它γ疱疹病毒有跨种传播的风险。
KSHV和EBV具有广泛的细胞嗜性。细胞嗜性主要取决于病毒囊膜表面的糖蛋白H(gH)和糖蛋白L(gL)与特异性受体的结合。Ephrin受体酪氨酸激酶A2(ephrin receptor tyrosine kinase A2, EphA2)可作为EBV入侵上皮细胞的受体,也可作为KSHV入侵内皮细胞的受体。但是gHgL识别EphA2的分子机制尚不清楚。
通过体外生化实验,研究人员发现KSHV gHgL与EphA2的配体结合结构域(Ligand binding domain, LBD)之间的亲和力高于EBV gHgL与LBD的亲和力。研究人员进一步分别解析了KSHV及EBV gHgL与EphA2 LBD的复合物晶体结构,发现KSHV和EBV gHgL结合LBD的模式也非常相似,主要通过末端的gL与LBD结合。一方面gL的N端loop插入到LBD的疏水通道里,另一方面gL的Lloop2和β2折叠结合LBD的外周区域,形成较为稳定的相互作用。进一步分析发现,KSHV gHgL与LBD存在更大的相互作用面积及更多的相互作用数,是其亲和力高于EBV gHgL的原因。
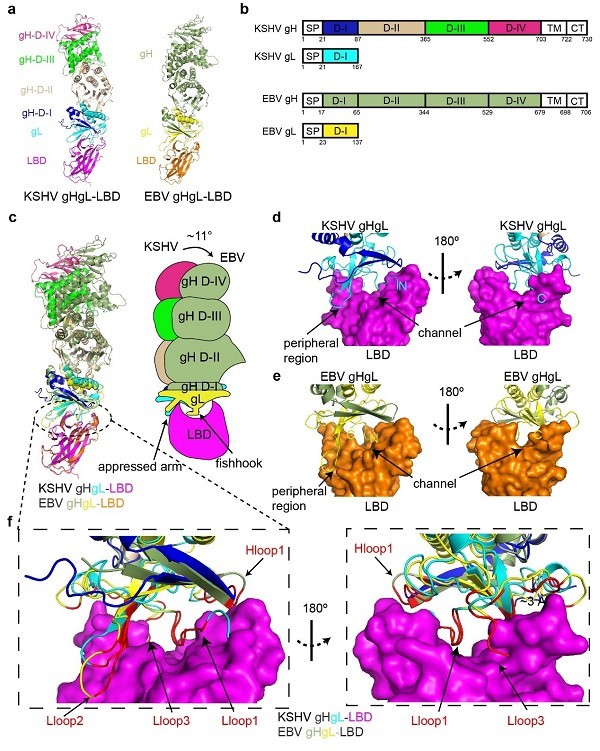
图1. KSHV和EBV gHgL分别与EphA2 LBD的复合物结构
此外,序列分析发现KSHV和EBV gL上参与结合LBD的氨基酸在γ疱疹病毒中相对保守,具备相似的氨基酸性质,因此推测其它感染哺乳动物的γ疱疹病毒是否也利用EphA2作为受体。研究人员进一步从γ疱疹病毒不同属中挑选了三种有代表性的病毒AIHV-1、EHV-2和MuHV-4进行验证。细胞融合实验证明这三种病毒的gHgL蛋白能结合宿主的EphA2,而且AIHV-1和EHV-2的gHgL也能结合人的EphA2,提示这些病毒具备感染人的潜力。
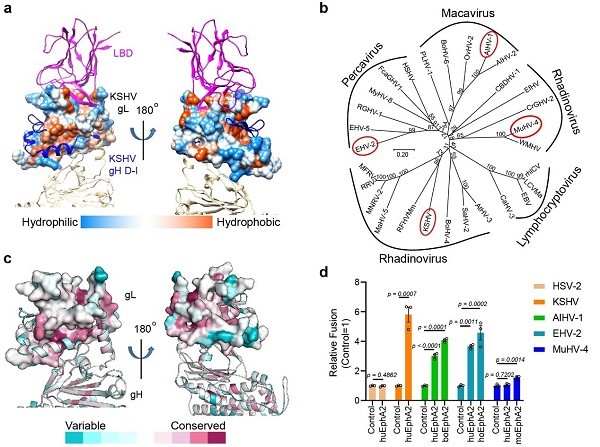
图2. EphA2可能是γ疱疹病毒的通用受体
国家蛋白质科学研究(上海)设施BL19U1线站,上海光源BL17U1线站工作人员为其X射线晶体学衍射数据收集提供了及时有效的支持。
(蛋白质设施上海提供)