



2020年11月23日,国际著名学术期刊美国科学学院学报PNAS发表了国家蛋白质科学研究(上海)设施用户中国科学院上海有机化学研究所生物与化学交叉中心刘聪课题组与其合作组的最新研究成果“ Hsp40 proteins phase separate to chaperone the assembly and maintenance of membraneless organelles”。该研究发现了一类维持无膜细胞器中蛋白稳态的关键分子伴侣Hsp40。其自身具有较强的相分离能力,并能够与无膜细胞器中的蛋白发生协同相分离,在维持蛋白质高度动态的相分离中起到关键的作用。
蛋白质的相分离是近几年的科研热点与难点,其在正常条件下可以执行多种重要生物学功能,尤其是在无膜细胞器动态组装中起到关键作用。而在疾病条件下,蛋白质相分离调控的紊乱会导致蛋白质从可逆的液-液相分离 (LLPS) 转变为不可逆的液-固相转化,形成不可逆的淀粉样聚集。这一不可逆的聚集过程与多种神经退行性疾病如肌萎缩侧索硬化症(ALS)等密切相关,具有十分重要的研究意义。
分子伴侣蛋白,也叫热休克蛋白,是维持细胞内稳态的重要蛋白家族,在蛋白的液液相分离过程中也起着十分重要的调节作用。目前已经发现多种不同的热休克蛋白家族存在于多种无膜细胞器中,但是它们在无膜细胞器动态组装中的作用机制的研究还非常匮乏。刘聪与李丹课题组长期合作致力于研究蛋白质不同形式相分离的结构基础,动态调控机制,以及在神经退行性疾病中的作用。本篇文章是首次发现分子伴侣蛋白(Hsp40)自身可以发生相分离,并且能通过自身相分离来调控不同无膜细胞器的组装以及稳态维持。本工作对于分子伴侣在无膜细胞器稳态的维持,以及蛋白分相调控紊乱与疾病关系的研究都具有重要的意义。
人源Hsp40共有三类亚型,A型、B型和C型,这三类亚型都具有保守的、参与Hsp70 ATP 水解的J domain。另外,A型、B型亚型的氨基端(NTD)除了J domain以外,还具有甘氨酸与苯丙氨酸富集的柔性区段—G/F 区域,以及紧随其后的包含底物识别结构域的羧基端(CTD)。本研究发现,Hsp40的A型、B型的两个重要成员—Hdj2、Hdj1在体外均具有较强的相分离能力,并且能参与细胞内多种无膜细胞器的形成(Fig.1)。机理研究发现,柔性G/F 区域中的多个苯丙氨酸及精氨酸残基对Hsp40的分相及其参与无膜细胞器组装至关重要。另外,由于G/F 区域在不同亚型以及不同种属的Hsp40普遍存在,进一步研究发现,酵母源Hsp40—Sis1以及Ydj1均具有较强的相分离能力,因此相分离可能为Hsp40蛋白的固有属性。
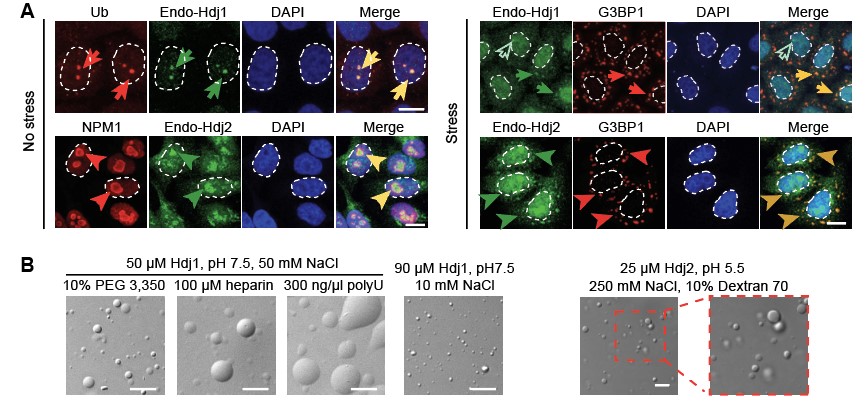
Fig.1 A. Hdj1与Hdj2定位于不同的无膜细胞器;B. Hdj1与Hdj2在不同条件下发生相分离。
作为分子伴侣的重要一员,Hsp40在细胞蛋白质稳态维持中发挥重要作用。Hsp40 的基因突变在多种神经退行性疾病中被发现,如ALS、帕金森症(PD)等。本研究发现,Hsp40能与ALS的关键致病蛋白FUS发生协同分相,并维持FUS液滴在高度动态的液体状态,进一步抑制其致病的液-固相转变。机理研究发现,Hsp40依靠其NTD暴露的精氨酸以及苯丙氨酸位点参与同FUS的协同分相,进一步其CTD中的底物识别结构域维持FUS液滴的稳态(Fig.2)。
综上,本研究首次发现并报道了具有相分离能力的分子伴侣—Hsp40,进一步阐明其相分离能力对无膜细胞器组装以及稳态维持的重要性。这对于无膜细胞器稳态维持分子机制的研究,以及相分离紊乱与疾病关系的研究具有重要的启示意义。
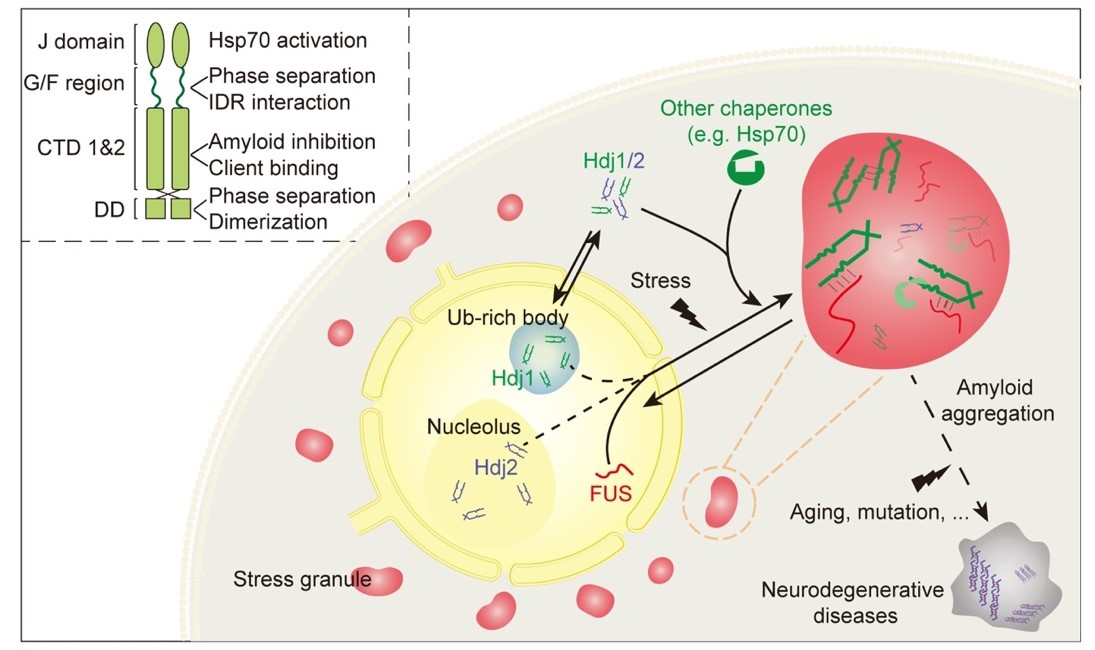
Fig.2 Hsp40 参与无膜细胞器形成及其稳态维持示意图
国家蛋白质科学研究(上海)设施核磁系统为该研究工作提供了大力支持,刘志军博士在900兆核磁谱仪上采集核磁图谱以及数据分析处理方面提供了支持与帮助。