科技动态
2021年5月24日,中国科学院上海高等研究院上海光源团队与中国科学院微生物研究所研究团队合作在Cell杂志上发表了题为“Binding and molecular basis of the bat coronavirus RaTG13 virus to ACE-2 in humans and species”的研究论文,提示我们要持续对动物源性冠状病毒进行监测,预防新的冠状病毒引发疫情。
病毒性传染病不仅严重影响人类健康,而且还造成了巨大的经济损失和社会恐慌。从2002年的萨斯病毒(SARS-CoV),到2012年的莫斯病毒(MERS-CoV),再到2019年的新冠病毒(SARS-CoV-2),三次冠状病毒疫情给世界公共卫生安全带来了巨大影响。类似的冠状病毒引起的疫情还会不会再发生,成为世界人民共同关心的科学问题。
在新冠疫情之初,科学家就发现RaTG13是目前发现的基因组序列与新冠病毒最相近的动物来源的冠状病毒。RaTG13是否存在潜在感染人及与人密切接触的动物的风险成为大家关注的焦点。
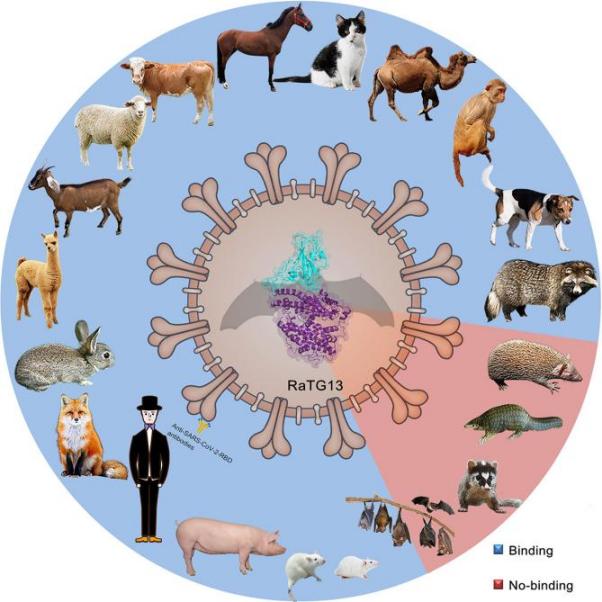
图1. RaTG13 受体结合域可结合多个物种ACE2
冠状病毒要感染宿主细胞,首先要和宿主特定的受体结合。获得与不同物种同源蛋白受体的结合能力,是病毒实现跨种传播的关键环节。因此,研究病毒和不同物种同源蛋白受体的结合,可用于评估病毒的跨种传播潜能、也可为病毒的起源提供线索。通过表面等离子共振技术(SPR)、细胞流式术以及假病毒感染等实验,研究团队发现RaTG13 的受体结合域(RBD)结合人ACE2,但是亲和力与SARS-CoV-2 RBD相比,降低了约100倍,二者的结合可以引起RaTG13假病毒对表达人ACE2的细胞的感染。此外,在研究的其他24个物种ACE2中,RaTG13 RBD可以结合18个物种的ACE2,值得关注的是SARS-CoV-2 RBD不结合大鼠、小鼠等物种ACE2,但是RaTG13 RBD可以,亲和力在μM级别。研究团队进一步解析了RaTG13 RBD和人ACE2的复合物晶体结构,发现与SARS-CoV-2 RBD相比,RaTG13 RBD在结合人ACE2时6个关键氨基酸存在差异。通过对这6个氨基酸进行单点突变实验,研究团队发现D501是影响RaTG13 RBD与ACE2结合谱的关键氨基酸。在RaTG13 RBD的基础上,将6个差异氨基酸同时突变为SARS-CoV-2氨基酸后,RaTG13 RBD结合人ACE2的能力提高至 SARS-CoV-2的水平。
围绕RaTG13的另一个重要的科学问题是,它与SARS-CoV-2的免疫原性差别有多大,目前研发的COVID-19疫苗和抗体药物是否可用于未来可能发生的RaTG13感染的治疗。研究团队发现COVID-19康复者血清中存在交叉识别RaTG13 RBD的抗体,且可以有效中和RaTG13的假病毒感染,并且研究团队前期开发的COVID-19治疗性抗体CB6可以有效中和RaTG13的假毒感染。
这些研究结果表明RaTG13存在跨越种间屏障,感染其他动物的潜在风险,提示我们要持续对RaTG13等动物源性冠状病毒进行监测,预防新的冠状病毒引发疫情。
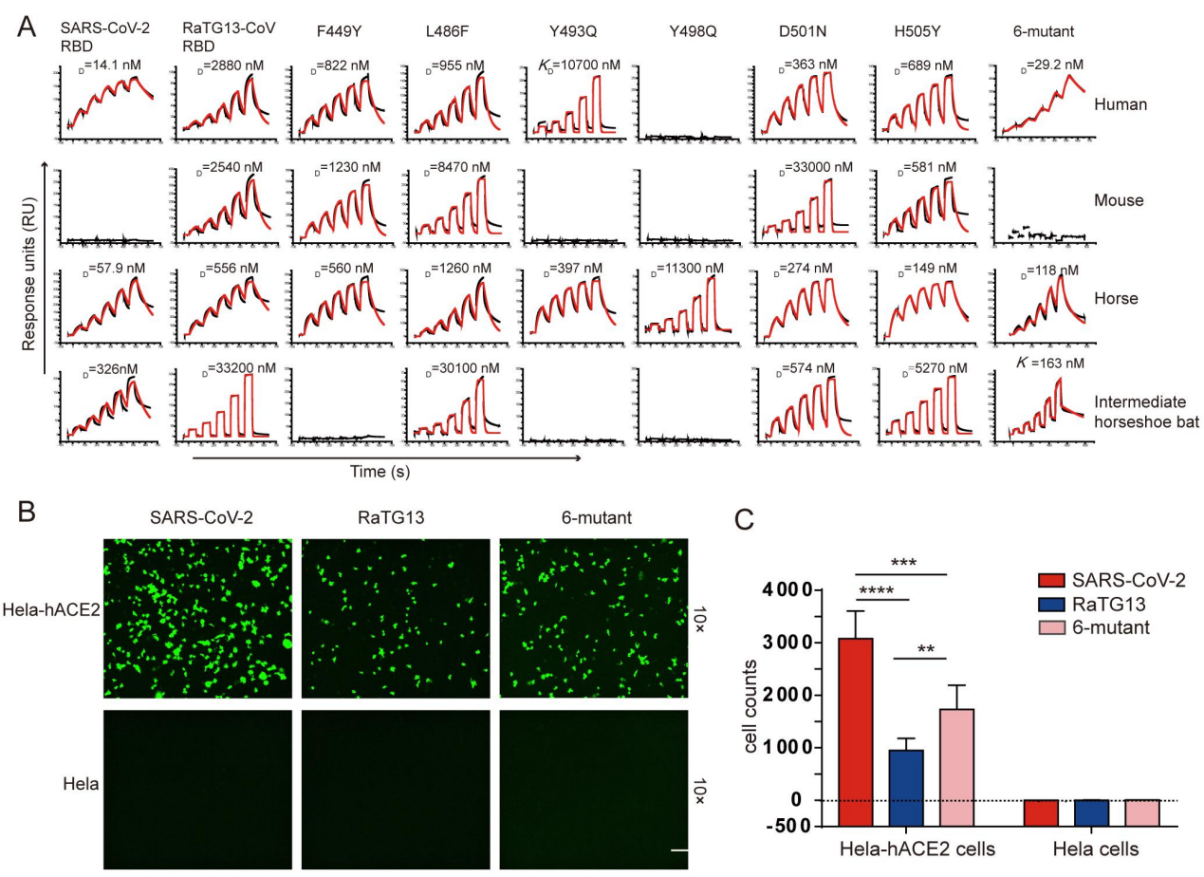
图2、 RaTG13 RBD与SARS-CoV-2 RBD结合hACE2的差异氨基酸对结合和入侵的影响
高福研究员带领的团队在冠状病毒跨种识别方面取得了一系列进展,发现SARS-CoV-2利用细胞膜表面的ACE2分子为受体感染宿主细胞,并揭示了SARS-CoV-2 RBD与人、猫、蝙蝠、穿山甲等物种ACE2相互作用的分子机制,研究团队还评估了SARS-CoV-2、RaTG13、GX/P2V/2017、 GD/1/2019等冠状病毒被不同物种ACE2识别的能力。
上海光源郁峰研究员为该研究的共同第一作者。国家蛋白质科学研究(上海)设施BL19U1线站(PDB: 7DRV)和上海光源BL17U1为其X射线晶体学衍射数据收集提供了及时有效的支持。



 打印
打印